Cambios de la materia
Los cambios pueden ser físicos o químicos. los que alteran su forman son cambios físicos. Los que alteran su naturaleza son químicos
Cambios Físicos
La materia cambia su apariencia, pero no altera su composición esto es un cambio físico
Cuando en los cambios físicos hay influencia del calor, hablamos de cambios progresivos y regresivos.
Los primeros ocurren cuando la materia pasa de un estado de mayor agregación a uno de menor agregación (solido a liquido, liquido a gas, o solido directamente a gas)

Cambios de Estado
Los cambios de estado son variaciones físicas.
Estos se producen por cambios en la energía calorífica y por la variación de la presión.

Vaporización
Pasaje de estado liquido a estado de vapor. Por ejemplo el agua liquida, cloroformo.
El alcohol, la acetona y los perfumes
Es el cambio de Estado de una sustancia que pasa de liquido a gaseoso cuando se calienta

Condensación
Es cuando del estado gaseoso se pasa al liquido y en este proceso el gas cede calor al entorno Un fenómeno similar ocurre cuando hierves un liquido con la olla tapada

Fusión
Cuando aumenta la temperatura a un solido las moléculas ganan energía y cambia de estado

Solidificación
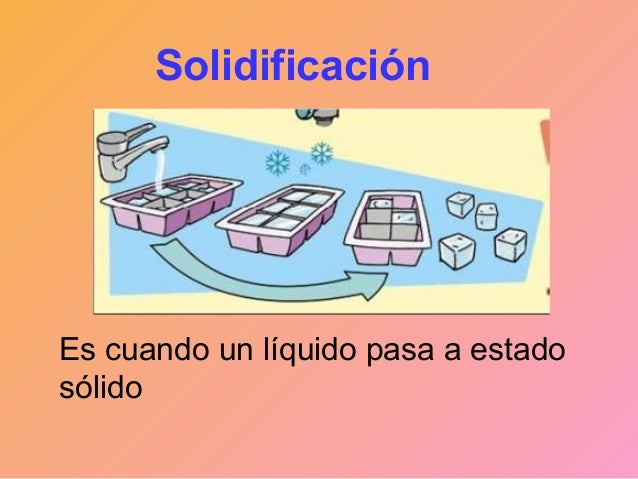
Es el cambio de un liquido a solido debido a la liberación de calor

Sublimación
Es el proceso por el cual una sustancia solida se traspasa directamente al estado de vapor sin pasar por el estado liquido. las sustancias solidas que presentan esta propiedad se transfieren sin fundir al estado de vapor.




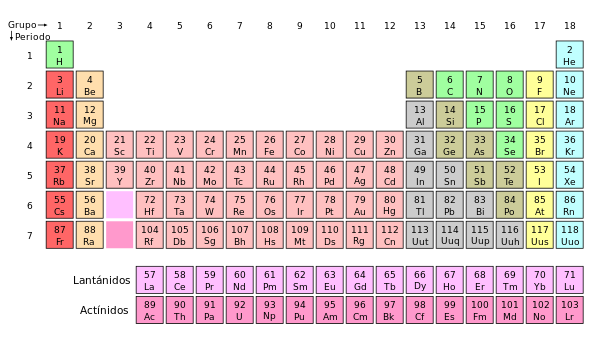
La tabla periódica y los elementos químicos










Cambios químicos
Cambios físicos.-Tienen lugar sin que se altere la estructura y composición de la materia, es decir, las sustancias puras que la componen son las mismas antes y después del cambio.
Cambios químicos.En un cambio químico o reacción química se altera la estructura y composición de la materia: de unas sustancias iniciales se obtienen otras distintas.
Los cambios químicos de la materia son cuando se dan reacciones químicas y los cambios pueden ser cambios de estado también de color, de sabor y de sus mismas propiedades como conducción de electricidad, de calor, su solubilidad etc
Vídeo de Cambios de la Materia
Evolución e historia de las teorías sobre la constitución de las materia
Los espectros atómicos
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 |  John Dalton |
|
| ||||||
| 1897 |  J.J. Thomson |
|
| ||||||
| 1911 |  E. Rutherford |
|
| ||||||
| 1913 |  Niels Bohr |
|
| ||||||
Los espectros atómicos
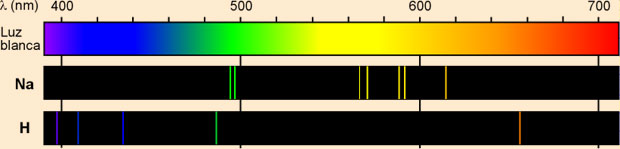 |
| El modelo atómico de Rutherford no podía explicar estas emisiones discretas de radiación por los átomos. Además presentaba el inconveniente de ser inestable: Según la física clásica una carga en movimiento emite continuamente energía por lo que los electrones radiarían energía continuamente hasta "caer" en el núcleo, con lo que el átomo se destruiría
El modelo atómico actual
|
La imposibilidad de dar una explicación teórica satisfactoria de los espectros de los átomos con más de un electrón con los principios de la mecánica clásica, condujo al desarrollo del modelo atómico actual que se basa en la mecánica cuántica.
También es conocido como el modelo atómico de orbitales, expuesto por las ideas de científicos como: E. Schrodinger y Heisenberg. Establece una serie de postulados, de los que cabe recalcar los siguientes:
- El electrón se comporta como una onda en su movimiento alrededor del núcleo
- No es posible predecir la trayectoria exacta del electrón alrededor del núcleo
- Existen varias clases de orbitales que se diferencian por su forma y orientación en el espacio; así decimos que hay orbitales: s, p, d, f.
- En cada nivel energético hay un número determinado de orbitales de cada clase.
- Un orbital atómico es la región del espacio donde existe una probabilidad aceptable de que se encuentre un electrón. En cada orbital no puede encontrarse más de dos electrones.
El modelo se fundamenta en los siguientes principios:
- Principio de onda-partícula de Broglie: Señala que la materia y la energía presentan caracteres de onda y partícula; que los electrones giran por la energía que llevan y describen ondas de una longitud determinada.
- Principio estacionario de Bohr: El mismo que señala que un electrón puede girar alrededor del núcleo en forma indefinida.
- Principio de incertidumbre de Heisenberg: Determina que es imposible conocer simultáneamente y con exactitud la posición y velocidad del electrón.
MODELO ATÓMICO ACTUAL
El átomo
Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas de sus ideas de mayor relevancia fueron:

| 
|
En el siglo V a. C., Leucipo sostenía que había un
sólo tipo de materia y pensaba que si dividíamos la materia en partes cada vez más pequeñas, obtendríamos un
trozo que no se podría cortar más. Demócrito llamó a estos trozos átomos ("sin división").
La filosofía atomista de Leucipo y Demócrito podía resumirse en:
1.- Los átomos son eternos, indivisibles, homogéneos e invisibles.
2.- Los átomos se diferencian en su forma y tamaño.
3.- Las propiedades de la materia varían según el agrupamiento de los átomos.
|
 |
En el siglo IV a. C., Empédocles postuló que la materia estaba formada por 4 elementos: tierra, aire, agua y fuego.
 | |
 |
Aristóteles, posteriormente, postula que la materia estaba formada por esos 4 elementos pero niega la idea de átomo, hecho que se mantuvo hasta 200 años después en el pensamiento de la humanidad.
 | |
La configuración electrónica del átomo


Se conoce como tabla periódica de los elementos, sistema periódico o simplemente como tabla periódica, a un esquema diseñado para organizar y segmentar cada elemento químico, de acuerdo a las propiedades y particularidades que posea.
Es una herramienta fundamental para el estudio de la química pues permite conocer las semejanzas entre diferentes elementos y comprender qué puede resultar de las diferentes uniones entre los mismos.

| Número atómico | Símbolo del elemento | Nombre del elemento |
|---|---|---|
| 89 | Ac | Actinio |
| 13 | Al | Aluminio |
| 95 | Am | Americio |
| 51 | Sb | Antimonio |
| 18 | Ar | Argón |
| 33 | As | Arsénico |
| 85 | At | Astato |
| 16 | S | Azufre |
| 56 | Ba | Bario |
| 4 | Be | Berilio |
| 97 | Bk | Berkelio |
| 83 | Bi | Bismuto |
| 107 | Bh | Bohrio |
| 5 | B | Boro |
| 35 | Br | Bromo |
| 48 | Cd | Cadmio |
| 20 | Ca | Calcio |
| 98 | Cf | Californio |
| 6 | C | Carbono |
| 58 | Ce | Cerio |
| 55 | Cs | Cesio |
| 30 | Zn | Cinc |
| 40 | Zr | Circonio |
| 17 | Cl | Cloro |
| 27 | Co | Cobalto |
| 29 | Cu | Cobre |
| 112 | Cn | Copernicio |
| 24 | Cr | Cromo |
| 96 | Cm | Curio |
| 110 | Ds | Darmstadtio |
| 66 | Dy | Disprosio |
| 105 | Db | Dubnio |
| 99 | Es | Einsteinio |
| 68 | Er | Erbio |
| 21 | Sc | Escandio |
| 50 | Sn | Estaño |
| 38 | Sr | Estroncio |
| 63 | Eu | Europio |
| 100 | Fm | Fermio |
| 114 | Fl | Flerovio |
| 9 | F | Flúor |
| 15 | P | Fósforo |
| 87 | Fr | Francio |
| 64 | Gd | Gadolinio |
| 31 | Ga | Galio |
| 32 | Ge | Germanio |
| 72 | Hf | Hafnio |
| 108 | Hs | Hassio |
| 2 | He | Helio |
| 1 | H | Hidrógeno |
| 26 | Fe | Hierro |
| 67 | Ho | Holmio |
| 49 | In | Indio |
| 77 | Ir | Iridio |
| 36 | Kr | Kriptón |
| 57 | La | Lantano |
| 103 | Lr | Lawrencio |
| 3 | Li | Litio |
| 116 | Lv | Livermorio |
| 71 | Lu | Lutecio |
| 12 | Mg | Magnesio |
| 25 | Mn | Manganeso |
| 109 | Mt | Meitnerio |
| 101 | Md | Mendelevio |
| 80 | Hg | Mercurio |
| 42 | Mo | Molibdeno |
| 60 | Nd | Neodimio |
| 10 | Ne | Neón |
| 93 | Np | Neptunio |
| 41 | Nb | Niobio |
| 28 | Ni | Niquel |
| 7 | N | Nitrógeno |
| 102 | No | Nobelio |
| 79 | Au | Oro |
| 76 | Os | Osmio |
| 8 | O | Oxígeno |
| 46 | Pd | Paladio |
| 47 | Ag | Plata |
| 78 | Pt | Platino |
| 82 | Pb | Plomo |
| 94 | Pu | Plutonio |
| 84 | Po | Polonio |
| 19 | K | Potasio |
| 59 | Pr | Praseodimio |
| 61 | Pm | Prometio |
| 91 | Pa | Protactinio |
| 88 | Ra | Radio |
| 86 | Rn | Radón |
| 75 | Re | Renio |
| 45 | Rh | Rodio |
| 111 | Rg | Roentgenio |
| 37 | Rb | Rubidio |
| 44 | Ru | Rutenio |
| 104 | Rf | Rutherfordio |
| 62 | Sm | Samario |
| 106 | Sg | Seaborgio |
| 34 | Se | Selenio |
| 14 | Si | Silicio |
| 11 | Na | Sodio |
| 81 | Tl | Talio |
| 73 | Ta | Tántalo |
| 43 | Tc | Tecnecio |
| 52 | Te | Teluro |
| 65 | Tb | Terbio |
| 22 | Ti | Titanio |
| 90 | Th | Torio |
| 69 | Tm | Tulio |
| 118 | Uuo | Ununoctio |
| 115 | Uup | Ununpentio |
| 117 | Uus | Ununseptio |
| 113 | Uut | Ununtrio |
| 92 | U | Uranio |
| 23 | V | Vanadio |
| 74 | W | Wolframio |
| 54 | Xe | Xenón |
| 53 | I | Yodo |
| 70 | Yb | Yterbio |
| 39 | Y | Ytrio |
Las Propiedades Periódicas
LAS PROPIEDADES PERIÓDICAS
Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemeneto en cuestión. Tal y como hemos dicho, vamos a encontrar una periodicidad de esas propiedades en la tabla. Esto supone por ejemplo, que la variación de una de ellas en los grupos o periodos va a responder a una regla general. El conocer estas reglas de variación nos va a permitir conocer el comportamiento, desde un punto de vista químico, de un elemento, ya que dicho comportamiento, depende en gran manera de sus propiedades periódicas.
Propiedades más importantes
Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos:
- Estructura electrónica- Radio atómico
- Volumen atómico
- Potencial de ionización- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Valencia iónica- Valencia covalente
- Radio iónico
- Radio covalente
Y también las siguientes propiedades físicas tienen una variación periódica:
- Densidad
- Calor específico
- Punto de ebullición
- Punto de fusión
Nosotros solamente vamos a describir las nueve primeras, pero en la Tabla Periódica interactiva de esta unidad encontrarás los valores de todas ellas correspondientes a cada elemento de la tabla.
Radio atómico
Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemeneto en cuestión. Tal y como hemos dicho, vamos a encontrar una periodicidad de esas propiedades en la tabla. Esto supone por ejemplo, que la variación de una de ellas en los grupos o periodos va a responder a una regla general. El conocer estas reglas de variación nos va a permitir conocer el comportamiento, desde un punto de vista químico, de un elemento, ya que dicho comportamiento, depende en gran manera de sus propiedades periódicas.
Propiedades más importantes
Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos:
- Estructura electrónica- Radio atómico
- Volumen atómico
- Potencial de ionización- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Valencia iónica- Valencia covalente
- Radio iónico
- Radio covalente
Y también las siguientes propiedades físicas tienen una variación periódica:
- Densidad
- Calor específico
- Punto de ebullición
- Punto de fusión
Nosotros solamente vamos a describir las nueve primeras, pero en la Tabla Periódica interactiva de esta unidad encontrarás los valores de todas ellas correspondientes a cada elemento de la tabla.
Radio atómico
Se define el radio atómico como la distancia más probable del electrón más externo al núcleo. Obsérvese que decimos distancia más probable, ya que según la mecánica cuántica, el electrón no se encuentra confinado en una órbita o trayectoria cerrada y solamente podemos hablar en términos de probabilidad de encontrar al electrón en un punto dado del espacio.
Conceptos próximos al de radio atómico son el de radio iónico y el de radio covalente que serían básicamente el mismo concepto indicado, salvo que se refiera a cuando el átomo está en forma de ión, en el primer caso, o formando una molécula diatómica con otro átomo igual en el segundo. Estas dos propiedades quedan fuera del alcance de nuestro propósito y por ello no hablaremos más.
De los datos experimentales que se conocen, se infiere que el radio atómico disminuye a lo largo de un periodo y por el contrario aumenta al descender en un grupo de la Tabla Periódica. Parece que esto es un contrasentido pues es de esperar que al aumentar Z, el átomo al poseer más electrones aumente de tamaño y que por tanto a mayor Z, mayor radio.
La explicación no es sencilla, tiene que ver con lo que se denomina "efecto pantalla" que, para explicarlo en términos fáciles de entender, no es otra cosa que el efecto que causan los electrones más internos en el electrón más externo. Hay que pensar que el electrón está sometido a la fuerza de atracción proveniente del núcleo y a la de repulsión debido a los otros electrones que tiene el átomo. Cuando estos electrones están en orbitales más internos (los que tienen n menor) el efecto es mayor que cuando residen en orbitales tan externos como el del electrón al que repelen.
Veamos primeramente la variación en un periodo. Cojamos para aclarar el segundo periodo que empieza con el Li=1s22s1 y que acaba con el Ne=1s22s22p6. Si nos fijamos, los siete electrones de diferencia que hay entre uno y otro, se han ido incluyendo en orbitales s o p con el mismo número cuántico principal (n=2), estos nuevos electrones son poco apantallantes y repelen poco al electrón más externo, mientras que el núcleo, de uno a otro elemento, ha aumentado en 8 protones. En el balance, la atracción nuclear supera a la repulsión electrónica por eso el radio disminuye.
En un grupo sucede lo contrario. Tomemos como ejemplo el primer grupo de la tabla periódica. Del H Z=1, al Ra Z=88, el núcleo adquiere 87 protones, pero los 87 electrones han ido ocupando orbitales más internos (dede n=1 hasta n=6) ocasionando un gran efecto pantalla. En el balance, la repulsión es muy grande frente a la atracción nuclear y esto permite que ese electón más externo esté poco atraído por el núcleo y por tanto el radio atómico aumente.
En la siguiente actividad interactiva podemos apreciar lo anteriormente dicho.


Propiedades de los elementos

Los Enlaces químicos de los compuestos
Un enlace químico es la interacción física responsable de las interacciones entre átomos,moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
Los químicos suelen apoyarse en la físico química o en descripciones cualitativas.
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participan tes. Las moléculas, cristales, y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia

Energía eléctrica
La energía eléctrica es causada por el movimiento de las cargas eléctricas en el interior de los materiales conductores. Esta energía produce, fundamentalmente, 3 efectos: luminoso, térmico y magnético

Corriente eléctrica
La corriente eléctrica o intensidad eléctrica es el flujo de carga eléctrica por unidad de tiempo que recorre un material. Se debe al movimiento de las cargas en el interior del material. En el Sistema Internacional de Unidades se expresa en C/s, unidad que se denomina amperio.

Electromagnetismo
El electromagnetismo es la parte de la electricidad que estudia la relación entre los fenómenos eléctricos y los fenómenos magnéticos. Los fenómenos eléctricos y magnéticos fueron considerados como independientes hasta 1820, cuando su relación fue descubierta por casualidad.

El campo magnético
La fuerza del magnetismo hace que un material apunte en dirección a los puntos de fuerza magnética. Como aparece en el diagrama de la izquierda, la fuerza magnética está ilustrada mediante líneas que la representa. En el diagrama, la fuerza del imán apunta del polo positivo al polo negativo. Como se aprecia en esta imagen, a un lado del imán se le llama polo positivo y, a la cara opuesta, polo negativo; la fuerza magnética fluye del lado o polo positivo, en dirección al polo negativo


El campo magnético terrestre
El campo magnético terrestre (también llamado campo geomagnético), es el campo magnético que se extiende desde el núcleo interno de la Tierra hasta el límite en el que se encuentra con el viento solar; una corriente de partículas energéticas que emana del Sol. Su magnitud en la superficie de la Tierra varía de 25 a 65 µT (microteslas) o (0,25-0,65 G).
Energía Nuclear
La energía nuclear es la energía que se obtiene al manipular la estructura interna de los átomos. Se puede obtener mediante la división del núcleo (fisión nuclear) o la unión de dos átomos (fusión nuclear).
Generalmente, esta energía (que se obtiene en forma de calor) se aprovecha para generar energía eléctrica en las centrales nucleares, aunque existen muchas otras aplicaciones de la energía nuclear.

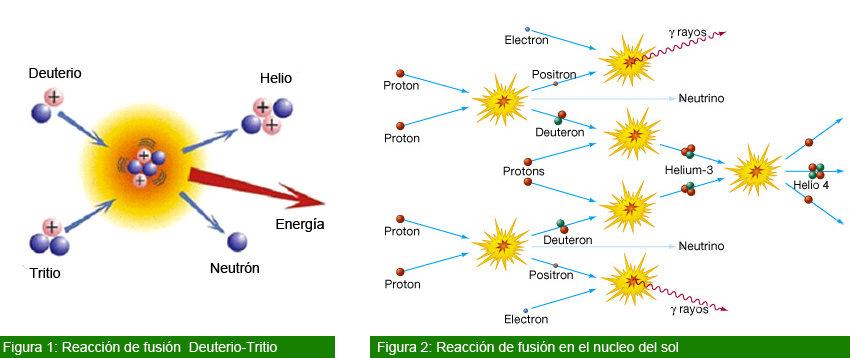
Fusión nuclear
La fusión nuclear es una reacción nuclear en la que dos núcleos de átomos ligeros, en general el hidrógeno y sus isótopos(deuterio ytritio), se unen para formar otro núcleo más pesado. Generalmente esta unión va acompañada con la emisión de partículas (en el caso de núcleos atómicos de deuterio se emite un neutrón). Esta reacción de fusión nuclear libera o absorbe una gran cantidad de energía en forma de rayos gamma y también de energía cinética de las partículas emitidas. Esta gran cantidad de energía permite a la materia entrar en estado de plasma.
Las reacciones de fusión nuclear pueden emitir o absorber energía. Si los núcleos que se van a fusionar tienen menor masa que el hierro se libera energía. Por el contrario, si los núcleos atómicos que se fusionan son más pesados que el hierro la esta expresión frecuentemente









No hay comentarios:
Publicar un comentario